
Si le microscope ne doit pas être considéré comme une panacée, mais simplement comme un élément parmi d’autres dans la détermination, il n’en est pas moins vrai qu’il constitue un outil indispensable pour l’étude de certains genres (Inocybes, Russules par exemple) et qu’il permet au débutant de faire des progrès rapides.
Croire que le microscope est réservé aux mycologues confirmés est une erreur; je pense même que le microscope est plus nécessaire au débutant! il permet de se forger une image plus complète d’un genre ou d’un sous-genre (spores bosselées et cystides de certains Inocybes, spores verruqueuses des Russules, cuticule celluleuse des Bolbitiées par exemple) et comprendre pourquoi certains genres qui se ressemblent sont séparés.

Le microscope est un dispositif optique permettant de grossir l’image d’un objet par le jeu de l’association de deux groupes de lentilles l’oculaire côté œil et l’objectif côté objet. La multiplication du grossissement de l’objectif par celui de l’oculaire permet d’obtenir le grossissement du microscope par exemple oculaire de 10 X objectif de 40 = grossissement de 400.
En mycologie on utilise en général des objectifs de 1OX, 40X et 100X (à immersion), associés à un oculaire de 10 ou 12X (très rarement 20X).
On commence par observer la préparation à un faible grossissement pour repérer les zones intéressantes, puis on passe à un grossissement supérieur.
Pour faire la mise au point on approche l’objectif (trop) près de la lame pour être obligé de s’en éloigner, afin de ne pas la heurter avec l’objectif pendant cette manipulation et risquer d’endommager l’un ou l’autre (l’optique est fragile).
Pour passer au grossissement supérieur, il suffit de tourner le revolver (dans le sens des aiguilles d’une montre) pour amener le prochain objectif. Sur les microscopes modernes les objectifs sont indexés de façon à ce qu’il n’y ait qu’une mise au point minime (avec la vis micrométrique) à faire lors du passage de l’un à l’autre.
A partir d’un grossissement de 1000X il est nécessaire d’observer en immersion pour augmenter le pouvoir séparateur. Pour ce faire on dépose une goutte d’huile à immersion (aujourd’hui synthétique, autrefois huile de cèdre) sur la lamelle couvre objet et on y trempe l’objectif (prévu à cet effet).
Ceci implique que l’on ne pourra pas passer d’un objectif « à sec » vers un objectif à immersion par simple rotation du revolver; il faut éloigner le corps optique de la préparation, amener délicatement l’objectif au contact de la lamelle (à noter que les objectifs à immersion sont pourvus d’un amortisseur permettant d’éviter de briser la lamelle) et refaire la mise au point. On peut éventuellement aussi déposer une goutte d’huile à immersion entre le condenseur et la lame.
En aucun cas on ne trempera l’objectif directement dans la préparation sans mettre de lamelle couvre objet.
Après usage il faudra essuyer systématiquement l’objectif à immersion avec un chiffon doux sec ou imprégné d’un peu d’alcool à 90° pour éviter que l’huile ne sèche. Eviter de toucher les lentilles avec les doigts, les nettoyer avec un chiffon doux ou un pinceau. Le microscope est un appareil fragile et donc à manipuler avec précaution et soin.
Le matériel nécessaire à une bonne pratique se compose:
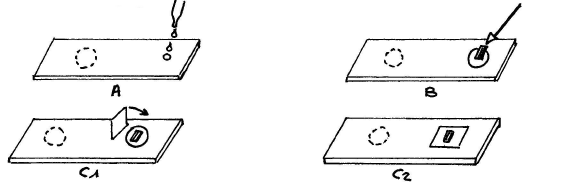
Les coupes
On peut bien sûr prendre un morceau (aussi petit que possible) de champignon, l’écraser entre lame et lamelle et essayer d’y voir quelque chose, mais si l’on veut éviter de parcourir toute la préparation avant d’y dénicher une cystide, connaître l’organisation d’un tissu ou localiser un élément avec précision, il faut recourir à des coupes.
L’observation au microscope se faisant par transparence, il faudra que les coupes soient les plus fines possible.
Contrairement à la Botanique, en Mycologie l’usage de la moelle de sureau n’est pas recommandé pour maintenir la pièce, sauf s’il s’agit de matériel sec non réhydraté.
Quelques principes:
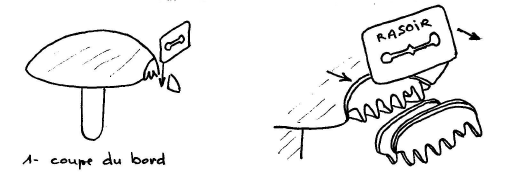
Le scalp
 Se pratique sur le chapeau, éventuellement sur le pied,
pour mettre en évidence la structure de la cuticule, du voile ou du revêtement
du pied. C’est certainement la coupe la plus facile à réaliser, il suffit
de "raser" le chapeau en se limitant le plus possible à la cuticule.
Se pratique sur le chapeau, éventuellement sur le pied,
pour mettre en évidence la structure de la cuticule, du voile ou du revêtement
du pied. C’est certainement la coupe la plus facile à réaliser, il suffit
de "raser" le chapeau en se limitant le plus possible à la cuticule.
Permet de voir si la cuticule est filamenteuse ou celluleuse (hyméniforme), éventuellement la présence de dermatocystides.
Coupe radiale ou transversale du chapeau
 Si
l’on veut mettre en évidence la structure cuticulaire et sous-cuticulaire,
il est nécessaire de faire une coupe transversale.
Si
l’on veut mettre en évidence la structure cuticulaire et sous-cuticulaire,
il est nécessaire de faire une coupe transversale.
0n pratique une incision à mi-rayon du chapeau, puis on "rase" les bords de la "faille" ainsi créée avec la lame du rasoir.
Permet une analyse fine de la cuticule et des couches inférieures, poils, dermatocystides, laticifères, mise en évidence d’hyphes primordiales incrustées par coloration à la fuchsine par exemple.
Coupe transversale des lames
 L’analyse
de la trame des lames, la recherche des pleurocystides (cystides de la face
des lames) nécessite ce type de coupe.
L’analyse
de la trame des lames, la recherche des pleurocystides (cystides de la face
des lames) nécessite ce type de coupe.
On coupe un morceau du bord du chapeau du champignon et on coupe ensuite le long de la "plaie" de haut en bas en commençant par la chair du chapeau et en finissant dans les lames, sans vouloir aller trop loin dans les lames. Il faut surtout s’attacher à faire des coupes fines. On obtient de petits "peignes".
Les basides et les éventuelles cystides tapissent le bord des "dents", tandis que la trame des lames pourra se voir à l’intérieur.
Examen de l’arête des lames
 Pour
mettre en évidence les poils d’arête ou cheilocystides on isole une lame
(ou un bout de lame) du chapeau et on coupe une petite bande aussi fine que
possible (1 mm environ) le long de l’arête. On réalise cette opération
directement sur la lame porte-objet dans un peu d’eau, et on écarte la
partie inintéressante de la lame du champignon après la coupe, on couvre avec
la lamelle couvre-objet. Parfois il suffit d’observer la préparation telle
qu’elle, mais le plus souvent il faut l’écraser un peu pour la rendre
lisible.
Pour
mettre en évidence les poils d’arête ou cheilocystides on isole une lame
(ou un bout de lame) du chapeau et on coupe une petite bande aussi fine que
possible (1 mm environ) le long de l’arête. On réalise cette opération
directement sur la lame porte-objet dans un peu d’eau, et on écarte la
partie inintéressante de la lame du champignon après la coupe, on couvre avec
la lamelle couvre-objet. Parfois il suffit d’observer la préparation telle
qu’elle, mais le plus souvent il faut l’écraser un peu pour la rendre
lisible.
Bien que la différence entre l’intérieur de la lame et l’arête soit souvent évidente, il vaut mieux repérer préalablement la position de l’un et de l’autre dans la préparation (mais ne pas oublier que le microscope donne une image inversée de l’objet).
Si l’observation de base doit se faire dans l’eau, il est cependant souvent nécessaire de procéder à des colorations pour mettre en évidence tel ou tel élément.
Congo ammoniacal
C’est une solution de Rouge Congo à 1% dans de l’ammoniaque concentrée (ne pas mettre le nez sur le flacon!).
Colore les parois des cellules en rouge.
Certains font systématiquement toutes leurs observations dans ce milieu; il est quasiment indispensable pour mettre en évidence les boucles, ou bien les cystides en brosse des Mycènes par exemple.
Réactif de Melzer
Le réactif de Melzer est une solution iodo-iodurée dans laquelle certains éléments dits "amyloïdes" réagissent en noir (violet) comme le fait l’amidon en présence d’iode. Il s’agit surtout des spores. Très utile pour mettre en évidence l’ornementation des spores de Russules par exemple.
Réactifs sulfo-aldéhydiques
Ces réactifs donnent une coloration grise à noire à certaines cystides ou dermatocystides (Russules). On utilise soit le sulfobenzaldéhyde (SBA) soit la sulfovanilline (SV). Mais ces réactifs se conservent très mal (moins d’un an parfois), aussi on utilise le plus souvent la SV qui se prépare au moment du besoin en dissolvant quelques cristaux de vanilline dans de l’acide sulfurique à 50%. Il faut savoir que dans ce milieu il n’est plus question de distinguer les hyphes du champignon, seules les cystides et les dermatocystides résistent en général à l’action de l’acide.
Fuchsine de Ziehl
Les hyphes cuticulaires présentent chez certaines Russules des incrustations acidorésistantes. Pour les visualiser, on plonge une coupe ou un scalp de cuticule dans une solution de fuchsine phéniquée (Fuchsine de Ziehl) pendant 10 minutes, on rince à l’eau, on trempe l’échantillon dans une solution d’acide chlorhydrique à 3% pendant 1 minute maximum, on rince à nouveau et on observe dans l’eau. On opère dans un petit godet (une capsule d’eau minérale fait l’affaire).
Les granulations acido-résistantes forment une gaine granuleuse rouge autour de certaines hyphes, alors que le reste est décoloré. Mais il faut faire attention de ne pas laisser agir l’acide trop longtemps, sinon toute la préparation finit par être décolorée.
Carmin acétique
La solution de carmin dans de l’acide acétique colore les noyaux de nombreux organismes et les granulations dites "carminophiles" ou "sidérophiles" du contenu des basides des Lyophyllées.
On place un petit morceau de lame dans une solution aqueuse de chlorure ferrique à 10% pendant quelques minutes, puis on le sort, le tamponne, puis on le place dans une solution de carmin acétique et on porte à ébullition pendant 1 à 2 minutes, on récupère l’échantillon, on le place dans une goutte de solution d’hydrate de chloral entre lame et lamelle, on écrase et on observe. La sidérophilie (ou carminophilie) est positive si des granulations noirâtres apparaissent dans les basides.
Bleu de crésyl
Permet la mise en évidence de la métachromasie de certains tissus ou cellules (coloration différente de celle de la solution). Peut être utile pour la détermination de certaines Lépiotes.
Un petit fragment de lame ou des spores sont déposés dans une goutte de solution de bleu de crésyl à 0,5% pendant quelques instants, puis on dilue avec de l’eau et on observe à l’immersion. Si les spores sont métachromatiques, l’endospore se colore en rouge alors que le reste est en bleu.
Bleu coton lactique
C’est une solution à 0,1% de bleu coton dans de l’acide lactique pur ou dilué de moitié. Colore le contenu cellulaire et certaines ornementations sporiques. Permet la mise en évidence de la "cyanophilie" (coloration bleue des spores ou des hyphes par le colorant).
Ammoniaque
L’ammoniaque (NH4OH) est obtenue par dissolution du gaz ammoniac (NH3) dans l’eau.
Elle peut avoir plusieurs utilisations, soit pour colorer (souvent en jaune) certains éléments comme le contenu des chrysocystides, soit pour regonfler le matériel sec en l’y faisant bouillir pendant quelques secondes.
Hydrate de chloral
A la propriété de gonfler les tissus, donc pour examiner un exsiccatum on peut également le faire bouillir pendant quelques secondes dans une solution aqueuse d’hydrate de chloral à 66,7%.
Dans la pratique, seules les trois premières colorations sont quasiment indispensables (et la fuchsine pour les Russules), les autres peuvent souvent être contournées, bien que lorsqu’on peut les mettre en œuvre elles simplifient la détermination.
Les éléments à observer au microscope chez un champignon donné peuvent varier d’un genre ou d’une espèce à une autre. On observera presque systématiquement les spores, très souvent les lames (cystides) et la cuticule, plus rarement les boucles ou autres détails.
La cuticule et les voiles
On prélèvera une partie des voiles (verrues, volve...) pour y rechercher d’éventuels sphérocystes (cellules rondes) volve d’Amanitopsis submembranacea par exemple, voile de certains Coprins, etc.
Le scalp des Bolbitiées (Agrocybe, Bolbitius, Conocybe...) et quelques autres espèces montrera des cellules rondes (cuticule celluleuse ou hyméniforme), alors que la plupart des champignons ont une cuticule filamenteuse (même les Russules dont la chair est pourtant majoritairement formée de sphérocystes).
Certains genres peuvent présenter des éléments particuliers:
On pourra éventuellement observer différents types de pigments : extracellulaires (grains solidifiés), membranaires et intracellulaires (vacuolaires).
Boucles
La boucle est une anse se produisant au niveau de la séparation entre deux hyphes et par laquelle un noyau d’une hyphe passe dans l’autre.
 C’est
un élément souvent difficile à détecter. On la cherche souvent à la base des
basides, mais quand elle existe, c’est au niveau de la cuticule que la
boucle est la plus facile à mettre en évidence.
C’est
un élément souvent difficile à détecter. On la cherche souvent à la base des
basides, mais quand elle existe, c’est au niveau de la cuticule que la
boucle est la plus facile à mettre en évidence.
Hyménium
Déjà lors de l’examen macroscopique, c’est l’hyménium qui nous donnait les renseignements les plus importants, il en est de même en microscopie.
L’examen de l’hyménium (partie fertile) permettra de distinguer les Ascomycètes (avec asques contenant 8 spores, et paraphyses) des Basidiomycètes (avec basides portant 4 spores, et cystides) dans les quelques rares cas où l’examen macroscopique ne permet pas de trancher.

Les cystides:
ce sont les éléments stériles des Basidiomycètes (les paraphyses étant ceux des Ascomycètes), on en distingue 3 types:
Quelques exemples de cystides:

D - Trame des lames:
L’examen de la trame des lames nécessite des coupes transversales
fines, il y a 4 possibilités: 
Spores
Au microscope on peut apprécier différents caractères des spores, y compris la couleur dans une certaine mesure (blanche, pâle, rousse, brune, noire).
On peut voir un éventuel pore germinatif, évaluer l’épaisseur de la paroi sporique, mais surtout voir la forme et l’ornementation de la spore et mesurer sa taille (avec un oculaire micrométrique).
Différents types de spores:

La forme et l’ornementation des spores est en général relativement homogène dans un même genre : tous les Entolomes ont des spores polygonales, toutes les Amanites et tous les Tricholomes (au sens strict) ont des spores lisses, toutes les Russules ont des spores verruqueuses plus ou moins crêtées.
La taille des spores varie pour l’essentiel de 3 à 20 microns (1 micron = 1/1000ème de millimètre) environ, avec une majorité de spores autour de 8 à 10 microns (µ).
Toutes les spores d’une même espèce n’ont pas forcément exactement la même taille, mais sont comprises dans une fourchette. Pour indiquer la taille on note d’abord les valeurs extrêmes de la longueur suivies des valeurs extrêmes de la largeur (ex: 9 - 12 µ x 6 - 8 µ dans le cas de Tricholoma pardinum).
Aussi pour mesurer la taille des spores il ne faut pas se limiter à une seule, mais en mesurer un grand nombre, et d’autre part opérer sur des spores mûres, c’est à dire sur des spores de sporée (en principe!).
Nous ne terminerons pas sans dire un mot des pièges à éviter, par exemple:
Malgré tous ces pièges à éviter, ces techniques à apprendre, ces tour de main à acquérir, vous verrez que la microscopie donne un intérêt décuplé à la Mycologie. Parfois aussi des doutes et des questions supplémentaires, mais c’est ce qui donne du charme à la chose et pousse à continuer!
Site de Marcel Lecomte sur la microscopie et les réactifs
chimiques: http://users.skynet.be/champignons_passion
Un autre site sur la microscopie avec plein de trucs et astuces à réaliser
soi-même: www.microscopies.com